Categorie: Fisica classica Meccanica quantistica
Tags: atomo elettroni particelle alfa protoni radioattività raggi catodici Rutherford Thompson
Scritto da: Vincenzo Zappalà
Commenti:8
La meravigliosa avventura dell’atomo. 3: panettoni con canditi o sistemi solari in miniatura? **
Per una trattazione completa, inserita in un contesto più ampio, dell’argomento affrontato in questo articolo, si consiglia di leggere il relativo approfondimento
La fisica e la chimica stanno avvicinandosi sempre più e le scoperte si susseguono a ritmo incalzante. Il modello di Dalton sta per crollare sotto gli attacchi dell’elettricità. Ma la MQ è pronta a uscire allo scoperto… La spettroscopia può finalmente descriverci le stelle.
Al punto in cui siamo arrivati diventa impossibile seguire con un minimo di attenzione tutte le scoperte scientifiche che si susseguono. Siamo perciò costretti a estrarre e ad analizzare solo quelle che si riferiscono strettamente all’atomo e alla sua struttura.
I fenomeni legati all’elettricità (soprattutto l’elettrostatica) sono noti da secoli e secoli e nel 1600 e 1700 s’inventano addirittura giochi da salotto sulle varie applicazioni dell’elettrostatica. Basta dire che già Talete nel 600 a.C. parla delle caratteristiche dell’ambra di attirare a sé oggetti leggeri. Non per niente, in greco antico, ambra ha come nome proprio elektron.
Se dobbiamo scegliere un vero punto di svolta, però, è forse conveniente partire da Franklin, il celebre inventore del parafulmine. Famosi sono i suoi esperimenti con i fulmini, ma soprattutto è fondamentale una sua enunciazione del 1750: “La materia elettrica consiste di particelle estremamente piccole e sfuggenti e può permeare tutta la materia comune, anche la più densa. Le particelle hanno una tale libertà e facilità di movimento da non ricevere nessuna apprezzabile resistenza”.
Si parla ancora di materia elettrica composta da particelle che convive con la materia comune, ma possiamo dire che l’elettrone fa la sua effettiva comparsa teorica. Il concetto teorico viene sviluppato in grande dettaglio, più di un secolo dopo, da Weber, nel 1871, e da Stoney nel 1891, che conia il nome elettrone, in cui la parte finale “one” in inglese significa “uno”, ossia unità. Lo stesso suffisso si applicherà a tutte le particelle future.
Tuttavia, la vera scoperta dell’elettrone avviene per via sperimentale attraverso il tubo catodico di Crookes, un tubo di vetro che contiene un gas molto rarefatto e che ha i due estremi (poli) collegati a un alimentatore in modo che un polo sia negativo (catodo) e uno positivo (anodo). All’interno di questo tubo viene inserita una “croce di Malta” e/o un mulinello a pale in grado di ruotare. Facendo passare corrente, il mulinello inizia il suo movimento rotatorio. Inoltre, la croce produce un’ombra sull’anodo o sulla parete di fondo (spesso è la croce stessa l'anodo). Esiste un “fascio” di qualcosa che percorre il tubo ed esso deve avere massa (ossia essere formato da particelle) e deve produrre luminescenza. Al flusso di “particelle” viene dato il nome di raggi catodici.
La Fig. 4 mostra un paio di tubi di Crookes, con tanto di croce di Malta e di mulinello. Va notato che Crookes è interessato all’azione delle scariche elettriche sui gas rarefatti e non riesce a interpretare esattamente ciò che ha scoperto sperimentalmente.
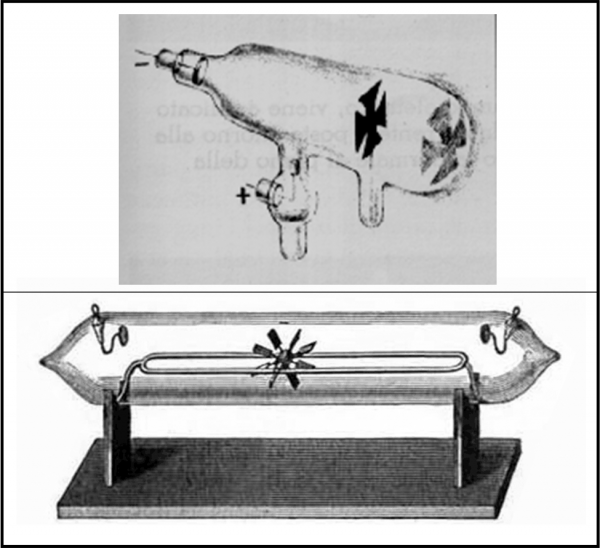
L’esperienza porta facilmente a concludere che i raggi catodici hanno le seguenti caratteristiche:
1) Sono formati da particelle che viaggiano in linea retta, in quanto sono in grado di produrre ombra.
2) Hanno una massa in quanto fanno girare la croce di Malta.
3) Hanno una carica elettrica negativa in quanto sono attratti dall’anodo.
4) Non dipendono né dal tipo di metallo che costituisce il catodo, né dal tipo di gas contenuto nel vetro. Infatti, variandolo, le particelle esistono comunque.
La sintesi dell’esperimento viene compiuta da Thompson, nel 1897, che è in grado di aggiungere due punti ancora più fondamentali:
5) Le particelle possono provenire sia dagli atomi che costituiscono il catodo, sia dal gas contenuto nel tubo.
6) Possiedono tutte lo stesso rapporto carica/massa.
In poche parole: esse sono tutte uguali tra loro ed esistono in tutti gli atomi. L’elettrone ipotizzato da Stoney è stato individuato sperimentalmente!
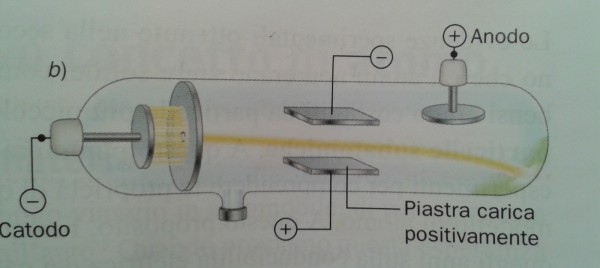
La parte più importante dell’esperimento di Thompson riguarda proprio il punto (6) e viene descritta inserendo un campo magnetico lungo la traiettoria dell’elettrone (Fig. 5). La deviazione subita dalla particella permette di determinare il rapporto tra carica elettrica e massa. Varrebbe la pena andare più a fondo, ma avremmo bisogno di introdurre la forza di Lorentz e il prodotto vettoriale. Ne parleremo in un articolo a sé stante, senza paura del linguaggio della matematica.
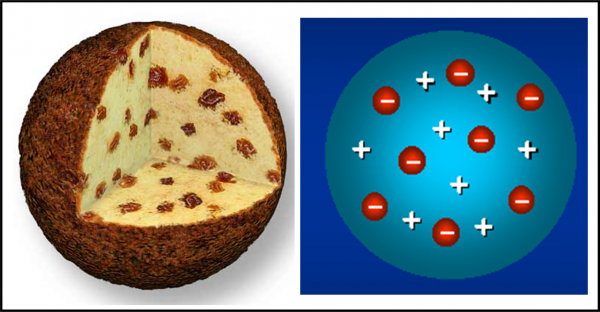
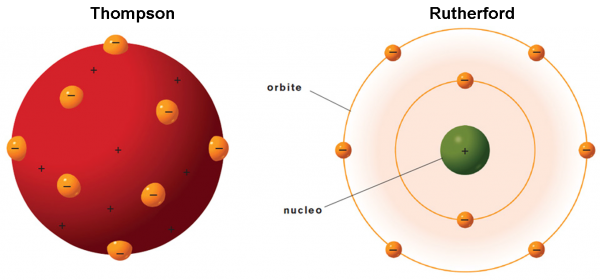
Torniamo al nostro … panettone. In realtà, il modello di atomo proposto da Thompson nel 1904 ricorda proprio un panettone “positivo”, in cui sono inseriti dei canditi “negativi”, gli elettroni. Definiamolo un po’ meglio.
Essendo la materia elettricamente neutra in condizioni normali, ogni atomo deve essere caratterizzato da una carica positiva uguale a quella degli elettroni che contiene. Gli elettroni devono anche essere estremamente più piccoli dell’intero atomo (almeno un migliaio di volte). Ne consegue che la massa dell’atomo, la “pasta” del panettone, ha carica positiva, mentre i canditi, che vi sono inseriti dentro, sono numerosissimi e hanno carica negativa (Fig. 6). Gli elettroni rimangono tranquilli nella pasta fino a quando la materia non viene eccitata, acquistando energia. Essi, allora, cominciano ad agitarsi emettendo onde elettromagnetiche (ossia la luce) o -addirittura- possono abbandonare l’atomo come nel caso dei raggi catodici.
Un modello senz’altro primitivo, ma che già contiene concetti estremamente corretti. Li possiamo notare proprio collegandoli con la QED appena analizzata. Gli elettroni quando si agitano o si spostano (seconda lettera dell’alfabeto di Alice) possono emettere o assorbire fotoni (terza lettera). Siamo, però, in un momento di attività scientifica frenetica e il modello di Thompson può durare ben poco, malgrado sia veramente geniale.
Prima di proseguire, ricordiamo che l’atomo di Thompson spiega l’esistenza degli ioni, ossia particelle con carica positiva e/o negativa. Gli elettroni rappresentavano gli ioni negativi, di valore unitario, mentre ciò che resta è uno ione positivo che, nel caso dell’idrogeno (atomo più leggero), viene pure considerato unitario. Nel frattempo, si è anche scoperta la radioattività, ossia la capacità di alcuni atomi di decadere in atomi più leggeri attraverso l’emissione di particelle cariche che possono essere positive come nel caso delle alfa (nuclei di elio). Pur non sapendo ancora cosa sono queste particelle, esse sono comunemente usate per produrre fasci a carica positiva.
A questo punto arriviamo al fondamentale esperimento di Rutherford del 1909. Lo scopo è, essenzialmente, quello di verificare la validità del modello di Thompson, ma i risultati sono sbalorditivi e non possono che farlo rifiutare.
Lo schema è riportato nella Fig. 7 . Particelle alfa vengono lanciate (la velocità è elevatissima) in modo da attraversare una lamina d’oro sottilissima (lo spessore è stato fatto variare, ma in media è di 0.01 mm). Attraversando gli atomi della sostanza, ossia la pasta che non oppone particolare resistenza, esse dovrebbero essere deviate solo leggermente e diffuse sulla parete di fondo. La misura di questa deviazione può far risalire alla distribuzione degli elettroni all’interno del loro piccolo panettone. Ovviamente, ci si aspettano deflessioni di pochi gradi. Teniamo presente che gli atomi sono considerati pieni e quindi vi deve essere un effettivo attraversamento di materia da parte delle particelle alfa.
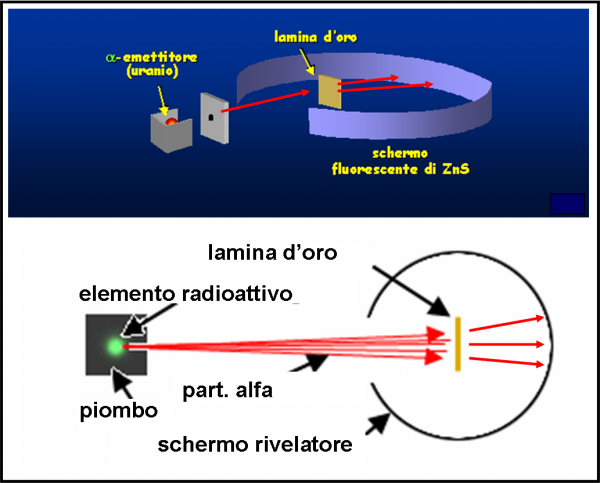
Ciò che, invece, capita è del tutto inatteso. Molte particelle non vengono assolutamente deviate, mentre altre mostrano deviazioni maggiori di 90°, ossia tornano letteralmente indietro!
La Fig. 8 mostra ciò che si ci attendeva con l'atomo di Thompson, colpito dalle particelle alfa e quello che invece succede. L’atomo deve avere quantomeno delle zone veramente vuote e altre talmente concentrate da far rimbalzare letteralmente le particelle. Lo stesso Rutherford dice: “E’ un evento incredibile. E’ come se avessi sparato con un fucile contro un foglio di carta velina e fossi colpito dal proiettile che è stato respinto indietro”
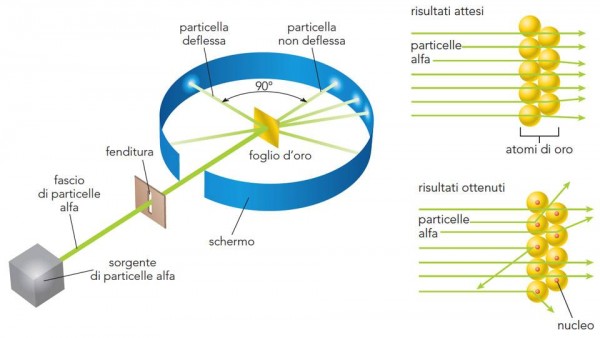
Rutherford interpreta così i risultati dell'esperimento:
la maggior parte delle particelle alfa sono passate senza problemi attraverso le regioni più esterne degli atomi, mentre le particelle restanti devono aver rimbalzato contro qualcosa, all’interno degli atomi, che sia molto piccolo, ma estremamente denso e di carica positiva.
Ciò sconfessa l’ipotesi che l’atomo sia una sfera omogenea e poco densa, ma fornisce gli elementi per una nuova ipotesi: “l'atomo deve avere un nucleo positivo”.
Utilizziamo quel poco che sappiamo sulle funzioni per vedere come esse siano utilissime per descrivere fenomeni fisici d’avanguardia (per l’epoca).
Per analizzare l’urto tra particella alfa e il nucleo d’oro, possiamo fare riferimento allo schema della Fig. 9.
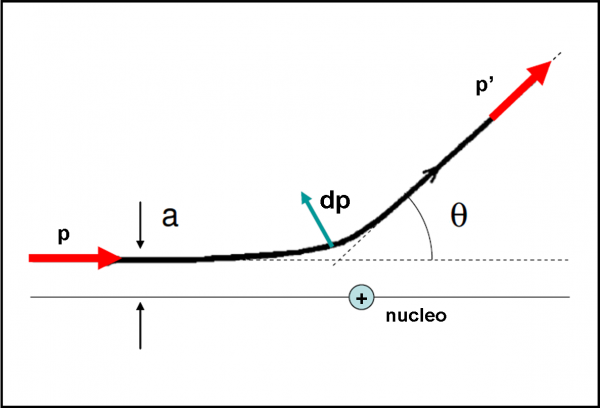
Dall’analisi esatta del problema, molto complesso, risulta che la traiettoria effettivamente seguita dalla particella è un’iperbole, con fuoco nel nucleo dell’atomo d’oro. La distanza a tra il fuoco e l’asintoto orizzontale dell’iperbole (ossia la traiettoria della particella alfa prima dell’incontro ravvicinato) viene chiamato parametro d’urto. Cosa capita alla particella? Essa cambia la sua quantità di moto p a causa della forza repulsiva del nucleo e continua secondo l’asintoto individuato dalla direzione di p’. Per valutare questo spostamento si può usare l’angolo ϑ, ossia l’angolo di deflessione.
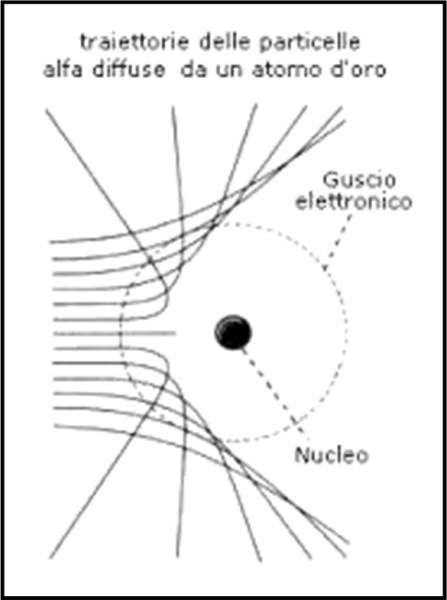
E’ facile concludere “qualitativamente” che più è grande il parametro d’urto e minore è l’angolo. Per parametri d’urto molto piccoli, invece, l’angolo può superare i 90° e, quindi, la particella può tornare indietro. In poche parole, abbiamo una famiglia di iperboli che descrive perfettamente l’interazione tra particella alfa e nucleo atomico, come mostrato dalla Fig. 10. Servono o non servono le funzioni? (tornate a studiarle… eh, eh, eh…).
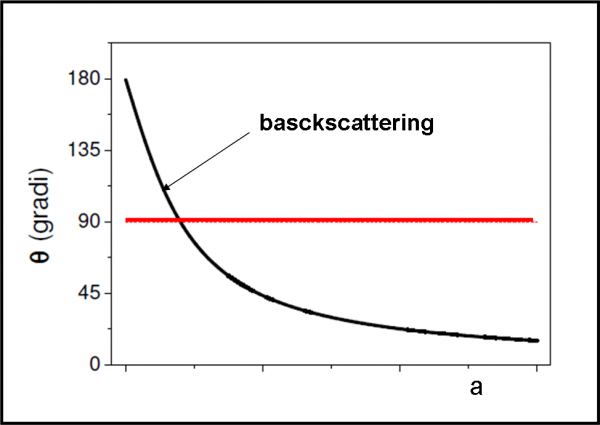
La situazione è stata semplificata di molto, ma dà un’idea più che sufficiente di ciò che ha dedotto velocemente Rutherford. Si può anche illustrare facilmente, in Fig. 11, la relazione tra angolo di deflessione ϑ e parametro d’urto a. La linea rossa indica l’angolo di 90°, ossia il valore limite per il rimbalzo completo delle particelle alfa. E’ il celebre backscattering di Rutherford, ossia il “rimbalzo”.
Ovviamente, è un evento che capita molto raramente e per saperne di più potreste sempre chiedere a Feynman e alla sua QED. Potremmo, infatti, formulare l’evento nel seguente modo: una particella parte da A (sorgente delle particelle alfa) e deve tornare in A dopo aver “toccato” la lamina d’oro (non è molto diverso dalla riflessione sul vetro, ormai ben conosciuta…). Le lettere sono sempre le stesse e la parola finale è descrivibile con i diagrammi di Feynman (non è cosa ovvia, però…). Ovviamente, l’ampiezza è molto piccola… ma l’evento può capitare…
Chiudiamo questo inciso che è servito a far vedere come tutto è collegato a tutto, sia a livello QED sia a livello di studio elementare (o quasi) di funzioni. Meditiamoci sopra…
Ricapitolando, l’esperimento porta Rutherford alle seguenti conclusioni: le particelle alfa, nella maggior parte dei casi, oltrepassano la lamina d'oro senza subire deviazioni. Ciò significa che non incontrano alcun ostacolo sul proprio cammino e che, quindi, l'atomo deve essere formato prevalentemente da spazio vuoto. In qualche caso, però, le particelle vengono deviate e in rarissimi casi addirittura riflesse. Ne segue che l'intera carica positiva dell'atomo deva essere concentrata in un "nocciolo" piccolissimo e centrale: il nucleo.
E’ ora facile enunciare il suo modello atomico:
L’ atomo è essenzialmente vuoto: poiché le particelle alfa hanno una massa circa 7 500 volte maggiore rispetto a quella di un elettrone, per passare indisturbate oltre la lamina (e ciò accade per più del 99% di esse) non devono trovare ostacolo nelle masse dei singoli atomi di oro. La massa di ciascun atomo d'oro deve essere concentrata in una regione particolare: il nucleo.
Il nucleo è carico positivamente: il nucleo deve essere 104-105 volte più piccolo di quello dell'atomo e deve essere carico positivamente: solo così si possono spiegare le notevoli deviazioni nella traiettoria (anche con riflessione indietro, ossi con angoli ϑ maggiori di 90°) di un numero limitato di particelle alfa.
Il modello è di tipo planetario: dal momento che, in condizioni ordinarie, la materia è impenetrabile, bisogna supporre che gli elettroni debbano occupare, in qualche modo, la periferia dell'atomo (lo spazio intorno al nucleo). In prima approssimazione gli elettroni possono essere immaginati come i pianeti attorno al Sole.
L’ atomo è elettricamente neutro: il numero degli elettroni, carichi negativamente, deve essere uguale a quello delle cariche positive presenti nel nucleo, per cui l'atomo, nel suo complesso, è neutro.
Lo stesso Rutherford chiama protoni le più piccole particelle positive: il nucleo di un atomo neutro deve essere formato da tanti protoni quanti sono gli elettroni.
Malgrado l’esperimento e le conclusioni siano davvero rivoluzionarie e geniali, il modello di Rutherford dura molto poco. Basta la fisica classica a condannarlo rapidamente e aprire la strada alla MQ.
L’elettromagnetismo dice che ogni volta che una carica viene accelerata essa deve irradiare energia. Nel modello di Rutherford gli elettroni ruotano attorno al nucleo e, quindi, devono possedere un’accelerazione centripeta (notate l’importanza del moto circolare uniforme) e quindi devono emettere energia. Perdendo energia in modo costante devono anche rallentare il loro moto e , di conseguenza, la loro orbita decade (come capita per i satelliti artificiali e non solo). Prima o poi gli elettroni devono cadere sul nucleo. Questo, però, NON capita. Se gli elettroni cadessero sui nuclei, la materia stessa si “sgonfierebbe” (in realtà lo fa, ma sotto condizioni molto particolari, come sappiamo bene dalla “morte” di certe stelle…). Non solo, però: le osservazioni dicono che le emissioni elettromagnetiche risultano discontinue (righe spettrali).
Come vedete siamo arrivati a bomba, ossia alle righe spettrali. Solo la MQ può spiegarci sia il modello atomico che le righe degli spettri stellari. E’ ora che intervengano i pacchetti d’energia e la nuova interpretazione di Bohr.
E’ perfino un peccato che l’atomo di Rutherford sia durato pochissimo, talmente è innovativo. Forse è per questo che si continua a usarlo in tante scuole? Tuttavia, questo è il destino delle grandi scoperte: mettono subito in condizioni di fare il passo successivo. Rutherford, perciò, ha avuto un’importanza fondamentale e le grandi scoperte non si misurano con la loro durata temporale. Oltretutto, il succo del modello (nucleo e elettroni molto distanti) rimane inalterato anche nell’ottica dell’onnipresente principio d’indeterminazione di Heisenberg (vedi quiz che avevo proposto qualche giorno fa).






8 commenti
FINALMENTE!!!!!!!!!!!!!!!!!!!!






si riprende a volare
caro Alvy,
Hai ragione... ma sto scrivendo l'inizio della spettroscopia e aspetto di avere abbastanza materiale da poter avanzare sia verso l'atomo a "salti" che verso le righe spettrali. Le due cose devono viaggiare di pari passo...
Enzo sei un SUPERPROFESSORE.
Modello di Rutherford: gli elettroni che ruotano intorno al nucleo, immaginiamo un moto circolare uniforme, devono emettere radiazioni. Per il principio di conservazione dell'energia questo significa che gli elettroni dovrebbero acquisire continuamente energia: da dove? C'entra qualcosa il fatto che le cariche in moto generano campi magnetici?
Nel caso di un ipotetico pianeta - ipotizziamo sempre un'orbita circolare e moto circolare uniforme - cosa succede? Anche qui c'è da attendere che il pianeta emetta energia (per esempio radiazione infrarossa) per annullare il bilancio energetico? Se si, quali energie di scambio si devono prendere in considerazione? Oppure l'elettromagnetismo prevede qualcosa di diverso dalla gravitazione?
In fondo il campo elettrico ha la stessa formula del campo gravitazionale (fisica classica).
Non ti avvicinare troppo agli stambecchi (mi riferisco ai maschietti), sono decisamente poco socievoli!!!
Caro Enzo, come avrai capito mi piace riflettere ed approfondire gli argomenti trattati.
Dato che recentemente sto leggendo i tuoi articolo sulla matematica (come potrò mai ringraziarti, è da anni che volevo colmare le mie lacune e solo ora ho trovato l'opportunità di farlo) e sono giusto arrivato alle funzioni coniche (parte quarta), ne approfitto per vedere se ho compreso alcune questioni affrontate in questo articolo.
Una funzione, rappresenta la relazione che lega il variare di qualcosa (X) in funzione di qual cos'altro (Y) e viceversa.
Tale relazione può essere individuata matematicamente, con una macchina (Alice la chiamerebbe la macchina delle relazioni), che definisce con precisione proprio tale rapporto.
Tale rapporto può essere graficamente descritto usando il sistema di riferimento cartesiano ed ovviamente il valore della funzione che regola tale rapporto, disegnerà figure diverse (rette, ellissi, iperbole, ecc.) .
La deflessione descritta nelle figure 9 e 10 (esperimento di Rutherford ), può essere descritta anche come un rapporto tra la distanza elettrone vagante e nucleo dell'oro (a- parametro d'urto) e il valore dell'angolo ϑ di deflessione (che dipende dalla variazione di quantità di moto, p).
Al diminuire della distanza tra elettrone e nucleo, aumenta ϑ , ossia aumenta l'angolo di deflessione, mente all'aumentare di tale distanza, ϑ diminuisce. L'andamento di tali variazioni, corrisponde graficamente un'iperbole (figura 11).
Visto che abbiamo cominciato a conoscere l'alfabeto Alice (http://www.infinitoteatrodelcosmo.it/2014/08/29/feynman-e-la-qed-12-un-alfabeto-di-tre-lettere/ ; http://www.infinitoteatrodelcosmo.it/2014/09/04/feynman-e-la-qed-13-le-prime-parole/ http://www.infinitoteatrodelcosmo.it/2014/09/08/feynman-e-la-qed-14-atomi-cronometri-fasulli-e-pezzi-di-vetro/) , ho provato a descrivere l'evento con le lettere di Feyman (l'elettrone che parte dalla sorgente A, arriva vicino alla lamina e torna al punto di partenza).
http://www.astrobin.com/full/38892/H/
Il primo grafico a sinistra è la rappresentazione più semplice, l'elettrone parte da A, arriva in B (in prossimità dell'atomo di oro), dove succede qualcosa, e torna in A (At2 non è un altro punto dello spazio, ma è il punto A in un instante di tempo successivo).
Cosa succede in B?
Nei due grafici successivi ho cercato di entrare un po' più nel dettaglio di cosa accade in B, ossia il mutamento di traiettoria dell'elettrone che rimbalza è preceduto da uno scambio di informazioni attraverso fotoni tra elettrone e nucleo (protoni) e/o elettrone vagante ed elettroni del guscio dell'atomo di oro (probabilmente si staranno dicendo: Scansati che mi stai venendo addosso!).
Il calcolo delle probabilità si affina rispetto alla prima rozza rappresentazione, con notevole riduzione della sua ampiezza (nel primo caso c'era un solo J, che vale 0,1, nel secondo caso ci sono 3 j, riduzione dell'ampiezza di probabilità a 0,001).
In realtà l'ampiezza è ancor più ridotta, poiché affinché l'evento si realizzi l'atomo di oro (sia che si tratti di protone o elettrone del guscio) deve trovarsi proprio in quel punto della spazio-tempo e deve assorbire ed emettere due fotoni (per cui si aggiungono almeno altri due J, con riduzione dell'ampiezza di probabilità a 0,00001).
Si potrebbe continuare così, affinando sempre di più i calcoli, ma va ben oltre le mie limitate capacità.
E' comunque evidente che per esempio aumentano lo spessore della lamina d'oro, aumentano anche le probabilità che un elettrone incroci un nucleo atomico, un po' come accadeva con il vetro ed il fenomeno dello scattering e della riflessione.
Ciò che volevo sottolineare è che l'evento sembra dipendere da tre fattori: che ho evidenziato in nero, blu e rosso nel calcolo di probabilità.
Il nero sono percorsi diretti, il rosso rappresenta l'evento che determina il cambio di rotta, ed il blu il contenuto informativo, ossia lo scambio di informazioni (sotto forma di pacchetti di energia?).
Non ho idea se questa ricostruzione e scomposizione dell'evento in fattori simili, sia corretta, però, personalmente la trovo utile.
Paolo
caro Alvy,
no! gli stambecchi sono pacifici e innocui (a meno che non gli metti due dita negli occhi...)
Comunque erano ancora troppo in alto e ci siamo "accontentati " di qualche camoscio e un paio di marmotte...
Nel campo elettromagnetico è obbligatorio fornire energia, non in quello gravitazionale. Un elettrone in movimento genera un campo magnetico, ma se accelera perde energia perché irradia (ossia emette fotoni). Nel campo gravitazionale una particella non emette niente Il riscaldamento solare invia fotoni che vengono o riflessi o assorbiti e poi rilasciati (ricorda il corpo nero...).
Il modello di Rutherford non può funzionare con un modello planetario, proprio perché ci vuole continua energia per mantenere in orbita gli elettroni, che già si sapeva dovevano emettere energia se acceleravano. Ecco perché c'è stato bisogno di quello di Bohr...
caro Paolo,
tieni presente che abbiamo imparato a fare diagrammi relativi solo allo scattering e quindi al caso 1 e 3 (entrambi sono esempi di come far cambiare direzione a un elettrone). Tieni anche presente che nel caso dello specchio eravamo interessati a quanto facevano i fotoni e avevamo come mezzo il vetro con le sue caratteristiche e poi VOLEVAMO che i fotoni uscenti arrivassero al rivelatore. Nel caso che stiamo affrontando adesso NON siamo interessati alla riflessione (angoli uguali), ma ci va bene qualsiasi tipo di angolo di deflessione dell'elettrone. Inoltre, i rapporti con il nucleo erano stati solo accennati. Perché ti dico tutto questo? Perché non siamo in grado di descrivere esattamente cosa succede all'interno della lamina d'oro. Tuttavia, le tue rappresentazioni sono indicative del fatto che quello che succede avviene in modo simile. Ci troviamo di fronte a scattering multipli e mai a un vero impatto elettrone-nucleo (come hai perfettamente intuito). Direi che 1 e 3 possono essere considerati sicuramente ottime indicazioni di cosa porta alla figura con gli elettroni che rimbalzano o passano attraverso (è come l'attraversamento nella lamina di vetro: nessun scattering o più scattering che vanno in una certa direzione). Il 2 ha un senso, ma è troppo semplificato.
L'applicazione è ottima, ma non può essere una reale rappresentazione dell'evento in termini di diagramma di Feynman. D'altra parte capirai che non possiamo approfondire troppo la questione. Puoi, comunque, ritenerti più che soddisfatto di aver capito perfettamente che chi comanda la dispersione degli elettroni ( e dei fotoni) non è altro che la QED. E, anche se ti sembra poco, ti assicuro che è un grande passo in avanti!!!!!
Non ti faccio più complimenti, ma... te li meriti sempre...
cari tutti,

questo articolo sta diventando uno dei più "cliccati". In un momento in cui i media parlano solo di cibo (per noi, però e non per chi ha veramente fame... Expo insegna...) come non entrare in un link dove compare panettone e uvetta? Ricette veramente astronomiche!!!