La chimica della vita: Idrogeno (H)
Oggi esaminiamo, dunque, l’importanza dell’idrogeno(H) nell’ambito del vivente.
Come ben si sa, l’idrogeno è l’elemento più diffuso nel cosmo ed è usato come combustibile nelle stelle.
In chimica, l’idrogeno è il primo elemento della tavola periodica e appartiene al I gruppo A.
E' un atomo piccolino: intorno al suo nucleo orbita un solo elettrone. In questo caso abbiamo un protone che costituisce il nucleo dell’atomo e un unico elettrone che orbita intorno.
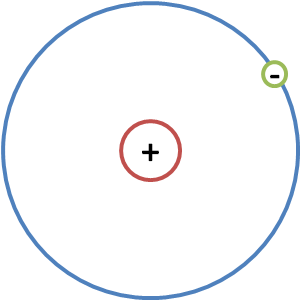
Come è coinvolto l’idrogeno per quanto riguarda l’ambito del vivente?
Idrogeno come molecola
L’idrogeno condivide il suo unico elettrone con altri elementi, stabilendo un legame covalente.
Il primo esempio è il legame con l’ossigeno(O).
L’ossigeno può dare vita a due legami. Dato che l’idrogeno può dar vita a un solo legame, l’ossigeno può legare due atomi di idrogeno e si forma una molecola molto importante per la vita, vale a dire H2O, cioè l’acqua.
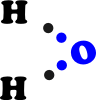
Con un solo elettrone a disposizione, l’idrogeno lega anche l’azoto (che in genere può stabilire tre legami) e il carbonio (che può stabilire quattro legami). Grazie a questo ruolo di “jolly” completa gli atomi di carbonio e azoto che non hanno impegnato tutti i legami per costruire le molecole del vivente.
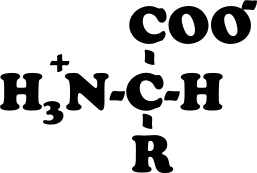
Idrogeno come ione
Se dall’idrogeno viene tolto l’unico elettrone, allora l’unica carica positiva data dal protone prevale e si forma lo ione idrogeno (H+), carico appunto positivamente.
Ciò conferisce ad esso il potere di rendere una soluzione acida, neutra o basica. Il meccanismo per ora non interessa ai fini del discorso. Molto sinteticamente diciamo che è coinvolto anche un altro ione, OH-, che ha carica negativa. L’equilibrio tra i due determina lo stato della soluzione.
Questo influisce sulla qualità e resa delle reazioni chimiche e sulla possibilità di formazione di vari composti, alcuni dei quali fondamentali per la vita.
Altro esempio. Il flusso attraverso membrana di H+, insieme ad elettroni liberatosi da reazioni chimiche, porta alla produzione di energia da parte delle cellule.
Legame a idrogeno
L’idrogeno, come detto, è un atomo piccolo. Un nucleo con un protone (carico positivamente) e un elettrone che orbita intorno (carico negativamente). Trattandosi di una sola orbita, quest’atomo per stabilizzarsi deve raggiungere solo due elettroni. Per cui la soluzione più comune è il legame covalente.
L’idrogeno, infatti, condividendo il suo unico elettrone, completa l’orbita. I più comuni legami covalenti, nel vivente, dell’idrogeno sono con ossigeno, carbonio e azoto.
Nel precedente articolo, abbiamo affermato che il legame covalente non è altro che una condivisione di elettroni tra atomi.
Consideriamo un legame classico, come quello tra idrogeno e ossigeno. L’idrogeno condivide il suo unico elettrone con l’atomo di ossigeno. L’ossigeno fa lo stesso. Gli elettroni di legame “orbitano” intorno ai due atomi.
Ogni elemento ha una propria elettronegatività. Semplificando, è la capacità di un elemento di attrarre verso di sé gli elettroni di legame, vale dire una sorta di forza di attrazione, un po’ come la forza di gravità tra gli astri.
L’ossigeno è più elettronegativo dell’idrogeno. Questo ha particolari effetti sugli elettroni di legame. La coppia di elettroni condivisa tende a stare più dalla parte dell’ossigeno che dalla parte dell’idrogeno. È come se l’idrogeno, in alcuni istanti, perdesse il suo elettrone dal suo controllo rimanendo con il solo protone. Ci sarebbe una prevalenza di carica positiva. L’ossigeno, dal canto suo, è come se avesse in più un elettrone rispetto ai protoni posseduti. È come se acquisisse una carica negativa. In realtà non si formano degli ioni, ma si parla di parziale carica negativa (per l’ossigeno) e parziale carica positiva(per l’idrogeno).
N.B. Gli atomi sono formati dallo stesso numero di protoni ed elettroni. Acquisire o perdere un protone o un elettrone porta a una prevalenza di protoni o elettroni. L’atomo di idrogeno ha 1 protone (+) e un elettrone (-). Togliendo l’elettrone avremo 1 carica positiva e zero negative con prevalenza della prima.
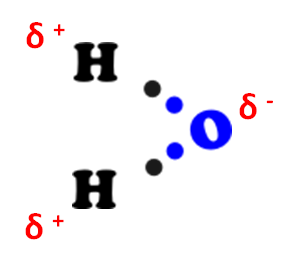
Questo crea particolare proprietà in alcune molecole.
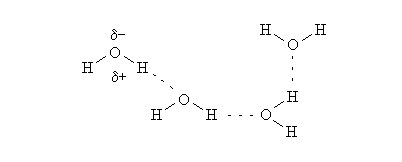
Dal disegno vedete come da un lato ci sono gli atomi di idrogeno e dall’altro l’ossigeno. Il legame ossigeno – idrogeno crea le parziali cariche positiva e negativa nella molecola d’acqua. Si crea una nuova forza di attrazione, il legame a idrogeno, grazie alla quale l’atomo di idrogeno di una molecola d’acqua attira verso di se l’ossigeno di un'altra molecola. Ciò conferisce all’acqua delle particolarità di cui, magari, parleremo in un seguente articolo.
Riassumendo. Quando l’idrogeno è legato a un elemento molto più elettronegativo, si crea la parziale carica positiva da parte dell’idrogeno stesso, mentre l’atomo più elettronegativo assume la parziale carica negativa. Si crea un “dipolo”. La parziale carica positiva attira verso di sé l’atomo più elettronegativo di un'altra molecola creando appunto il legame a idrogeno.
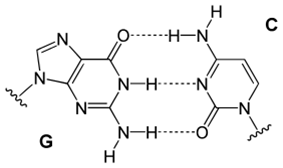
Il legame a idrogeno è sfruttato anche dalle molecole della vita. Senza andare molto lontano con il ragionamento, pensiamo al DNA.
Il DNA è costituito da due filamenti formati, a loro volta, da una successione di nucleotidi, i mattoni di base del codice genetico. I vari nucleotidi di un filamento creano legami con i nucleotidi complementari dell’altro filamento, creando la classica doppia elica del DNA. Questi legami non sono altro che legami a idrogeno.
In sostanza, l’idrogeno, elemento diffuso nel cosmo, utile a fare da combustibile per le stelle, ma che si rivela molto utile per far funzionare gli esseri viventi terrestri.
(peppe)






6 commenti
Caro Peppe,
vedo che nella figura 3 (l'amminoacido) l'atomo di azoto dà vita a quattro legami: uno con il carbonio e tre con l'idrogeno, mentre poco prima hai scritto che l'azoto normalmente stabilisce tre soli legami. Vedo anche il segno + in prossimità dei tre atomi di idrogeno: è quel più a spiegare l'arcano oppure fa semplicemente coppia con il meno che si vede sulla destra per far notare che la molecola è un dipolo?
Grazie e complimenti.
scusami alvy, la mia inesperienza a scrivere articoli mi ha fatto spiegare male un concetto, o meglio ometterlo.
il fatto di creare una parte di molecola parzialmente carica positiva o negativa è ok.
avevo scritto il dipolo, senza specificare. non è detto che molecole parzialmente cariche formino il dipolo.
L'acqua lo è perchè, la disposizone dei suoi atomi formano un angolo tale da portare tutti gli idrogeni, quindi tutte le parziali cariche positive, da una parte, e l'ossigeno, la parziale carica negativa, dall'altra. Il dipolo si crea, quindi, quando le parziali cariche positive si trovano da una parte e le parziali cariche negative si trovano in modo opposto.
credo che la calamita abbia una configurazione simile. corregetemi se sbaglio.
Per quanto riguarda l'amminoacido. non è stato usato per dimostrare il dipolo. se hai notato non si trova nel paragrafo dei legami a idrogeno. volevo semplicemente dimostrare come l'H aiuti l'atomo di carbonio centrale a completare i suoi legami.
lega cioè le varie specie chimiche, il gruppo amminico, il gruppo carbossilico ed R, ma manca un altro legame. questo legame lo occupa l'idrogeno.
per quanto riguarda l'azoto. io ho scritto "in genere" e non "normalmente"

L'azoto in genere compie tre legami per stabilizzarsi ma alle volte non disprezza il quarto legame con l'idrogeno. ma compiendo questo ulteriore legame, si carica positivamente, diventando lo ione ammonio.
il COO- è giustificato perchè l'idrogeno dello ione ammonio proviene proprio da tale gruppo. perdendelo si carica negativamente.
se vuoi più dettagli possiamo accordarci
c'è un particolare meccanismo alla base di ciò. Diciamo che la struttura dell'amminoacido, convenzionalmente, è meglio scriverla come in figura 3, con le cariche
vedi le ore mattutine cosa fanno.
l'amminoacido si comporta come un dipolo
scusate nel precedente commento invece di "proviene proprio da tale gruppo" è meglio dire "è come se provenisse". in realtà in questo gioco di formazione dell'amminoacido in figura 3 è implicata la molecola d'acqua.
Ione di carbonio, atomo di idrogeno, elettrone di ossigeno, .....Terra
Qualcuno sa dirmi come avviene il meccanismo chimico della 'deaminazione' e quello della 'transaminazione'.