Categorie: Fuori sequenza
Tags: cattura neutronica età stelle nucleosintesi processo s temperatura stelle
Scritto da: Vincenzo Zappalà
Commenti:10
Misurare la “febbre” delle stelle **
Essi non riguardano più la fusione nucleare, ma la cattura di neutroni. Normalmente, questi processi sono legati alla fase di supernova, ma avvengono anche in condizioni particolari, quando l’energia a disposizione è nettamente inferiore. Approfitto di un articolo scritto molto tempo fa per collegarmi al caso particolare.
E’ stato un sogno per secoli e secoli, ma senza alcun risultato pratico. Di cosa parliamo? Del miraggio degli alchimisti: la trasformazione del comunissimo Ferro nel preziosissimo Oro. Forse lo faceva Re Mida con l’aiuto (o punizione) divina, ma altre prove storiche non esistono.
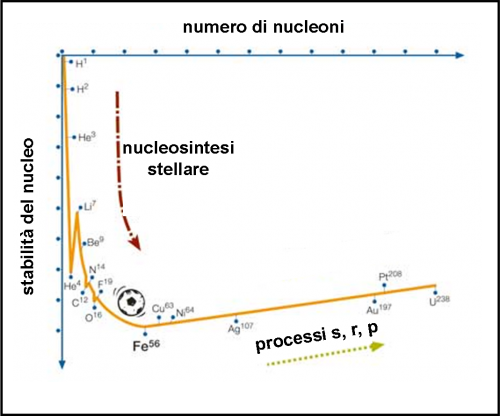
Ebbene, la faccenda è complicata anche per l’Universo ed esso ha dovuto aspettare la morte delle prime stelle massicce per riuscire in questo difficile compito. Sappiamo ormai molto bene che stelle come il Sole possono giungere nella loro fusione del nucleo solo fino all’ossigeno. Ci vogliono stelle ben più massicce per ottenere le temperature e le pressioni necessarie a creare “cipolle” stellari che arrivino a produrre elementi più pesanti. Ma anche queste hanno un limite: il Ferro 56, ossia con 56 nucleoni (protoni e neutroni), il che vuole anche dire un isotopo con 26 protoni e 30 neutroni.
Questo elemento è il più stabile che si conosca e non esiste temperatura e pressione in grado di farlo fondere. Poveri alchimisti… lo avessero saputo, non ci avrebbero nemmeno provato! La figura che segue mostra l’andamento della stabilità del nucleo (ossia l’energia di legame nucleare) in funzione del numero di nucleoni. Come si vede il Ferro 56 raggiunge il valore massimo.
Eppure sappiamo benissimo che in qualche modo l’Universo è riuscito ad andare oltre. Come ha fatto? Presto detto: ha cambiato tecnica, non più la fusione nucleare, ma la cattura di neutroni all’interno dei nuclei atomici. I neutroni, benché a carica nulla, sono estremamente importanti nell’Universo, in quanto -a differenza dei protoni- decadono spontaneamente e velocemente (in solo otto minuti) e si trasformano proprio in protoni (decadimento beta).
Il problema sta allora nell’avere a disposizione molti neutroni, in grado di essere catturati. Ciò non può capitare, normalmente, all’interno delle stelle e bisogna aspettare un fenomeno di energia spaventosa, in grado di cambiare violentemente le condizioni in cui si trovano le particelle. Non è cosa facile. Nella fusione si andava in discesa: bastava riscaldare e fondere. Ora, invece, comincia la salita: bisogna fornire “qualcosa” per andare avanti.
Il neutrone è una particella molto particolare, da un lato fortunata e dall’altra sfavorita dalla sorte. Non avendo carica elettrica può superare tranquillamente le barriere che i protoni sollevano verso particelle di uguale carica. Il suo “passaporto” gli permette di entrare dove vuole e di cambiare come vuole il nucleo atomico. Però, ha anche un gran difetto, come già accennato: se non si “accasa” convenientemente nel nucleo, decade in solo otto minuti e si trasforma in un protone, più un elettrone e un antineutrino. Tanta fortuna per sopravvivere pochi minuti…
All’Universo, però, questo mix di fortuna e sfortuna fa un grosso favore. Se un nucleo di Ferro 56 si rimpinza di neutroni niente cambierebbe, dato che si sarebbe creato solo un isotopo molto pesante. Tuttavia, se i neutroni che si sono aggiunti sono troppi, l’elemento diventa instabile. I neutroni appena arrivati decadono velocemente, trasformandosi in protoni. Eureka! Se nasce un nuovo protone aumenta il numero atomico e si può andare ben oltre il Ferro. La strada è aperta verso l’Oro e anche l’Uranio, il più pesante tra tutti. L’Universo sì, che è un vero alchimista!
Quando nascono queste condizioni così particolari e sconvolgenti? Presto detto: durante l’esplosione di una stella che abbia già creato al suo interno un gran numero di atomi pesanti come il Ferro. Durante l’esplosione le velocità e il numero di neutroni liberi diventano impressionanti. E’ una vera e propria corsa di queste particelle alla ricerca di una nuova casa. Non hanno problemi a superare la barriera dei protoni e si affollano nei nuclei atomici. Qualcuno magari riesce a sistemarsi, ma la maggior parte è costretta a decadere e trasformarsi velocemente in protoni. Il gioco è fatto. Le supernove sono riuscite a realizzare il sogno degli alchimisti!
Questo processo viene chiamato “processo r”, o di “cattura veloce”. Il vero segreto di questo processo sta nel poter catturare il maggior numero di neutroni prima che questi decadano spontaneamente. Se ve ne sono tanti e viaggiano velocemente, gli otto minuti sono più che sufficienti a far sì che molti di loro siano ormai inseriti all’interno di nuclei atomici quando inizia il decadimento.
Grandi esplosioni, “grandi” (o meglio “pesanti”) elementi. Piccole esplosioni, “piccoli” (o meglio “leggeri”) elementi.
Esiste, infatti, un altro processo in grado di produrre elementi più pesanti del Ferro. Non fa un granché, ma è sempre meglio che niente. Le stelle come il Sole mostrano anch’esse una fine (o meglio “trasformazione” finale) non proprio tranquilla. Quando non hanno più combustibile si raffreddano e diventano nane bianche. In questa fase si producono neutroni liberi. Non tanti e nemmeno troppo veloci. Tuttavia, bastano perché almeno uno di loro si infili nei nuclei di quel poco Ferro che queste stelle avevano recuperato dalle loro antenate esplose precedentemente. Attraverso questa “cattura lenta” o “processo s” si formano elementi come il Bario, il Rame, l’Osmio, lo Stronzio, e il Tecnezio.
Qualcuno potrebbe dire: “Perché invece di usare i neutroni e aspettare il loro decadimento, non si usano direttamente i protoni? Sarebbe ben più facile aumentare il numero atomico!”. Teoricamente sì, ma non è semplice inserire un nuovo protone all’interno di un nucleo atomico. I suoi amici residenti fanno di tutto per tenerlo lontano, a causa della sua carica elettrica uguale. Bisognerebbe superare questa forza di repulsione che è fortissima.
Ogni tanto ci si riesce, ma le condizioni devono essere molto particolari. Ancora un volta abbiamo bisogno delle stelle doppie.
Per essere “ammesso” nel nucleo, un protone libero deve essere molto energetico, per cui questo processo avviene solo a temperature estremamente alte. Se le due stelle del sistema sono abbastanza vicine, sappiamo bene che una delle due può iniziare a rubare materiale alla compagna (attraverso il famoso punto lagrangiano che separa i rispettivi lobi di Roche). Questo materiale fornisce un flusso di protoni liberi, abbastanza caldi ed energetici da superare la barriera alzata dai protoni del nucleo e fondersi con loro. Lantanio, Rutenio e Samario sono elementi tipici prodotti in questo processo, detto di “cattura protonica” o “processo p”.
Come si è capito bene, dei tre processi quello veramente fondamentale è la cattura veloce, o “r”. Ora è chiaro il motivo dei continui insuccessi degli alchimisti dei secoli passati: non erano in grado di creare una supernova nei loro laboratori segreti!
A questo punto, facciamo un passo indietro e studiamo meglio il processo s. Abbiamo visto che è una specie di ripiego, utilizzato da stelle di massa relativamente piccola come il nostro Sole quando si trasformano in nana bianca. Tuttavia, in stelle poco più grandi (fino a tre volte la massa solare) in una loro fase evolutiva avanzata si verificano le condizioni per il processo s. Parliamo della fase di ramo asintotico delle giganti.
E’ un momento in cui si formano isotopi pesanti che vengono trascinati in superficie tramite impulsi ricorrenti della stella che cerca di bruciare l’idrogeno degli strati attorno al nucleo e, ogni tanto, l'elio del nucleo. una respirazione molto affannosa e violenta. Ricordiamo, però, che anche stelle di grande massa, possono utilizzare il processo s poco prima di esplodere come supernove e dare il via al processo r, molto più efficace. Tanto per dire tutto e il contrario di tutto, si è notato il processo s anche in stelle di massa minore a quella del Sole (classe M). La vera differenza sta nel tipo di isotopi che si riescono a costruire attraverso la cattura lenta dei neutroni.
A noi interessa, in particolar modo, quella che dà origine a due elementi particolarmente interessanti: il Tecnezio (Tc) 99 e il Niobio (Nb) 93 (questi numeri si riferiscono al numero di massa, mentre il numero atomico dei due elementi è 43 e 41, rispettivamente), che si riferiscono a stelle da 0.8 a 8 masse solari. Ricordiamo che : numero atomico = numero di protoni o elettroni, numero di massa = numero di nucleoni.
Perché sono così importanti questi elementi radioattivi? Perché decadono molto in fretta. Il 99Tc, ad esempio, ha un tempo di dimezzamento di solo 200 000 anni. Ne consegue che se viene osservato in una stella esso non può riferirsi a residui presenti nella nebulosa da cui si è formata. Lo deve avere costruito lei in tempi molto recenti. Ma se l’ha costruito lei, diventa immediatamente una specie di cronometro che indica l’età della stella e la temperatura della sua parte interna. Infatti, la trasformazione e il trascinamento verso le zone superficiali devono avvenire sotto certe condizioni particolari, che sono un po’ troppo complicate per essere descritte in dettaglio, ma che indicano abbastanza esattamente la temperatura e l’età della stella.
Vale la pena ricordare ciò che aveva detto Eddington nel 1926 riguardo alla temperature stellare: “Sembra proprio che l’interno del Sole e delle stelle, in generale, sia uno dei luoghi più inaccessibili dell’Universo. Quale strumento potrà mai penetrare attraverso gli strati gassosi e giungere fino alla loro parte più interna?” Circa 90 anni dopo, si è avuta una parziale risposta.
Articolo originale QUI






10 commenti
Molto interessante una domanda anche le stelle antiche quelle dette di prima generazione potevano produrre elementi "pesanti" e poi sempre a quei tempi esistevano già i cosi detti mattoni per la formazione della vita come la conosciamo in pratica una forma di vita simile alla vita sul nostro pianeta avrebbe potuto formarsi in tempi remoti sarebbero state a disposizione le sostanze necessarie? o è solo l'evoluzione delle stelle che ha portato a ciò?
Adrittura la vita si può essere già formata ed estinta varie volte in varie fasi dell'evoluzione stellare.
Grazie Enzo.
caro Foscoul,
le prime stelle si sono formate con quello che c'era a disposizione allora: solo idrogeno ed elio (e un po' di litio). Loro hanno formato i primi elementi pesanti regalandoli allo spazio. Le stelle creano sempre le stesse cose. Ovviamente, dopo la prima generazione l'abbondanza di elementi pesanti era nettamente inferiore e non si pensa che sia stato sufficiente a creare composti organici complessi (ma mai dire mai...). Più si va avanti e più elementi pesanti si formano e più facile è la formazione della vita. Quanto possa durare una vita è un problema non certo risolto, dato che ne conosciamo una sola... Ovviamente, tecnologia a parte, non più della vita della stella...
bell'articolo enzo,una domanda più o meno inerente(spero).... fin dalla formazione planetaria,poi dalle piogge meteoritiche o dagli scontri planetari(come quello che avrebbe
formato la nostra luna) si evince che tutta la materia ha avuto nei miliardi di anni un più o meno totale rimescolamento degli elementi.... nel centro della terra vi è un nucleo di ferro fuso e man mano verso la superficie (e poi nell'atmosfera) elementi sempre più leggeri,come mai il nostro pianeta è ricco di metalli anche pesanti accessibili a noi,nella sua superficie?
Scusa Enzo c'è una cosa che non mi è chiara.
Nell'ultima parte dell'articolo, quando parli del processo S e degli isotopi Tecnezio e Niobio, il fatto che questi non possono ricondursi a residui presenti nella nebulosa che ha dato origine alla stella, è da intendersi che tali elementi (Tc e Nb) sono stati prodotti successivamente dalla stella, ma in ogni caso all'interno di tale stella devono esserci atomi di Ferro (originati da precedenti generazioni stellari) perché si possa innescare il processo . Oppure no?
Una piccola curiosità nella figura ho notato che nel passaggio da Elio 3 e poi Elio 4 il nucleo sembra stabilizzarsi, poi si destabilizza fortemente nel passaggio alla successiva fase di utilizzo del Litio 7 come “combustibile”..... soprattutto in quel frangente la variazione in termini di stabilità è così marcata... negli altri passaggi successivi tale variazione appare molto, molto, meno marcata.
Ti ringrazio per questo articolo, non sai quanti dubbi mi ha chiarito sulla formazione degli elementi più pesanti, che pur legandoli alle supernove (e quindi non al processo di fusione nucleare che si ferma la Ferro) ignoravo completamente i processi (R, S e P) con cui tale elementi si formano.
Paolo
caro Davide,
la differenziazione va intesa come andamento "medio". Qualcosa è di pesante è rimasto anche in superficie. Sicuramente con un'abbondanza piccolissima rispetto a quello di un oggetto indifferenziato, come un asteroide.
caro Paolo,
ottima domanda. Sì, in realtà si sfruttano gli atomi pesanti già presenti nella nebulosa di partenza, ma , a volte, si può anche salire di molto per guadagno progressivo di protoni ottenuti con il decadimento.
L'elio 4 è estremamente stabile (non per niente è la particella alfa...).
Mi hai dato un'ottima idea (non troppo faticosa): descrivere la radioattività spontanea, ossia i tre decadimenti alfa, beta + e beta - . Ancora una volta, la meccanica classica può bastare per averne un'idea sufficiente... la solita conservazione dell'energia e della quantità di moto. Senza dimenticare un po' di effetto tunnel... Ti ringrazio dello stimolo!
Grazie Vincenzo per la tua gentilezza e per la tua competenza
Caro Enzo, dopo ciò che hai scritto in relazione al fatto che i protoni non intrattengono rapporti di buon vicinato con i loro simili (stessa carica elettrica) mi stupisce che nessuno ti abbia chiesto come fanno i nuclei atomici a non andare in pezzi.
L'ambiente interno al nucleo è piuttosto tumultuoso, un pò quello che avviene nell'universo. Se non ricordo male il precario equilibrio (che a noi osservatori esterni sembra perfetto) viene mantenuto grazie alla continua trasformazione di protoni in neutroni e viceversa: ogniqualvolta la "pressione" dovuta all'eccessiva e "prolungata" contiguità tra protoni rischi di frantumare il nucleo ecco che .... le forze della QCD cambiano le carte in tavola! E' un continuo gioco a rincorrersi che produce stabilità.
Se ho scritto fesserie, mi puoi lapidare!
Questa storia mi serve per introdurre un altro apparente paradosso: se è vero che i neutroni (liberi) decadono in otto minuti, la vita delle pulsar non dovrebbe arrivare a dieci! Nelle pulsar i neutroni sono però sottoposti a condizioni di pressione e temperatura tali che, evidentemente, la materia riesce a conservarsi a lungo in quello stato.
Visto però che parliamo di soli otto minuti, c'è qualcuno che si sia posto il problema di capire quale può essere la vita media teorica di una pulsar? C'è qualche "trucchetto", come quello della QCD nei nuclei atomici, che garantisca lunga vita ai fari dell'universo?
Se esagero, bacchettami pure.
Caspita, ha ragione Alvemag. Forse siamo un po' (un po'?!) assonnati.
Aspetto con ansia le risposte.
caro Alvy,
sto proprio scrivendo i decadimenti radioattivi per fare ulteriore chiarezza sui processi nucleari spontanei.
Per la prima parte posso dirti che se il numero di protoni non è eccessivo, la forza di Coulomb riesce a essere equilibrata dalla interazione forte e quindi si ha stabilità. La trasformazione che dici tu fa parte di un decadimento e necessita di condizioni particolari.
Per le stelle di neutroni devi tener conto che a mano a mano che si va verso il centro della stella cresce il numero di neutroni catturati all'interno dei nuclei: essi quindi sopravvivono. La materia degenera anche per l'eccessivo numero di neutroni che si abbracciano nel nucleo. Proseguendo i neutroni riescono addirittura a sopravvivere isolati a causa della enorme pressione a cui sottoposti che frena il decadimento. Le reazioni che esistono in tali condizioni sono solo in parte comprese e ancora si viaggia nelle ipotesi...